 I prioni sono proteine che se ripiegate in maniera errata provocano malattie neurodegenerative incurabili e molto invalidanti. Un team di scienziati della SISSA ha appena pubblicato una ricerca che analizza i fattori che influenzano i primi stadi del passaggio dalla forma buona a quella cattiva.
I prioni sono proteine che se ripiegate in maniera errata provocano malattie neurodegenerative incurabili e molto invalidanti. Un team di scienziati della SISSA ha appena pubblicato una ricerca che analizza i fattori che influenzano i primi stadi del passaggio dalla forma buona a quella cattiva.
“Quando sono sane assomigliano a una pallina, quando sono maligne a un cubetto”: così Giuseppe Legname coordinatore del Prion Biology Laboratory alla Scuola Internazionale Superiore di Studi Avanzati (SISSA) di Trieste descrive le proteine prioniche. I prioni sono proteine “ripiegate male” che provocano alcune malattie neurodegenerative incurabili, come le encefalopatie spongiformi (per esempio la cosiddetta “mucca pazza”) o la malattia di Creutzfeldt-Jakob. Legname e il suo team della SISSA hanno appena pubblicato uno studio che analizza nel dettaglio i meccanismi alla base dei primissimi stadi del ripiegamento errato. Lo studio è stato appena pubblicato sul Journal of the American Chemical Society, la rivista scientifica più autorevole del settore.
I prioni sono agenti infettivi molto particolari, sono cioè gli unici (a differenza di virus, batteri, funghi e altri parassiti) a non contenere DNA o RNA. Nonostante la loro apparente semplicità sono capaci di diffondere la loro azione patogena a macchia d’olio, “infettando” le proteine normali. PrPSc (la forma patologica della proteina prionica) infatti riesce a indurre altre proteine uguali, ma nella forma benigna (PrPC), ad assumere la conformazione sbagliata e diventare a loro volta nocive.
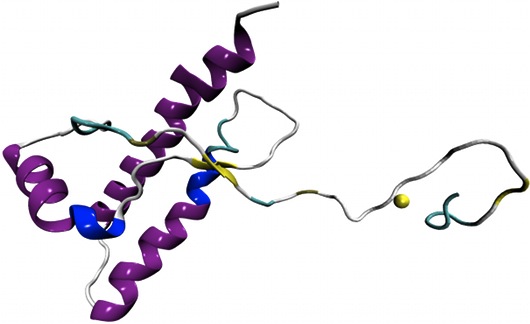
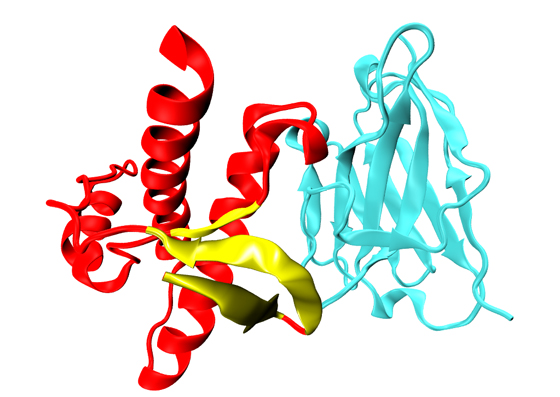
“Il nostro è uno studio sperimentale che per la prima volta osserva gli elementi strutturali che precedono il mutamento di forma maligno”, spiega Legname. “Abbiamo osservato ai raggi X alcune proteine prioniche sintetiche, assemblate da noi in laboratorio, utilizzando una metodologia nuova. Abbiamo inserito cioè dei nanobody, piccole proteine che fungono da impalcatura e spingono il prione a stabilizzare la sua forma”. Legname e colleghi hanno osservato che alla base del cambiamento di forma starebbe una zona specifica della proteina chiamata porzione “N-terminale”. “La proteina prionica è divisa in due sub-unità. La prima è la carbossi-terminale, che ha una forma molto strutturata e ben conosciuta. La parte N-terminale invece ha un aspetto più arruffato e senza una forma ben precisa e finora è stata poco studiata. È proprio questa la zona da cui inizia il ripiegamento patogeno del prione”, continua Legname. “È probabilmente la sua forma più lassa a garantire la dinamicità alla struttura che può quindi cambiare forma”.
“Lavori come il nostro sono i primi importanti passi per capire i meccanismi alla base dell’effetto patogeno del prione” conclude Legname. “Comprendere come avviene il processo di ripiegamento è fondamentale per individuare in futuro farmaci che lo blocchino, aprendo la strada a terapie per malattie oggi incurabili”.