 I riboswitch sono dei segmenti di RNA che “accendono” e “spengono” i geni, durante la trascrizione del DNA oppure durante la traduzione delle proteine, ma poco si sa dei dettagli con cui questo processo avviene. Uno studio della SISSA svela alcuni passaggi fondamentali di questo complesso meccanismo e apre la strada per studi futuri.
I riboswitch sono dei segmenti di RNA che “accendono” e “spengono” i geni, durante la trascrizione del DNA oppure durante la traduzione delle proteine, ma poco si sa dei dettagli con cui questo processo avviene. Uno studio della SISSA svela alcuni passaggi fondamentali di questo complesso meccanismo e apre la strada per studi futuri.
Una cellula è un ambiente complesso in cui le sostanze (metaboliti) devono stare nel giusto equilibrio, che può variare a seconda delle esigenze. La cellula può mantenere i livelli corretti di metaboliti regolando l’azione di codifica delle proteine da parte dei geni, con specifici “interruttori”, i riboswitch, che bloccano o attivano la sintesi. I dettagli del processo con cui questi brevi segmenti di RNA compiono questa funzione sono ancora poco noti, ma ora uno studio condotto da Giovanni Bussi, Francesco Colizzi e Francesco De Palma, tutti della SISSA, pubblicato sulla rivista scientifica RNA, ne delinea alcuni importanti dettagli.
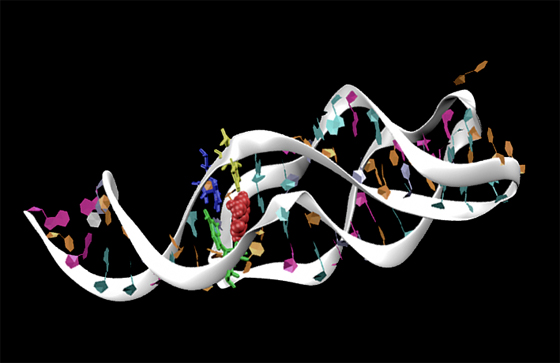
Un riboswitch è contenuto in una porzione di RNA messaggero, un frammento di RNA che agisce come una sorta di matrice che “stampa” le proteine importanti nel metabolismo cellulare. I riboswitch però a differenza del resto dell’unità di RNA messaggero non codificano per una porzione della proteina (fanno cioè parte di quello che i genetisti chiamano RNA non codificante) ma servono per attivare o disattivare il processo di stampa e si trovano, nei batteri, a monte della sequenza codificante. Gli scienziati sanno che quest’azione da interruttore avviene attraverso un cambiamento di forma, che ha luogo quando una porzione del riboswitch (detta aptamero) si lega a una molecola disciolta nell’ambiente cellulare che funge da segnale. Bussi e colleghi hanno usato delle simulazioni al computer per ottenere una riproduzione della dinamica del processo, per capire in che modo il legame con il metabolita provoca il cambiamento di forma.
In particolare Bussi e colleghi hanno simulato il riboswitch che usa come segnale una molecola di adenina, per regolare il gene che esprime una proteina coinvolta nel metabolismo dell’adenina stessa. Le loro osservazioni chiariscono come l’adenina stabilizzi la forma attiva del riboswitch (quella che attiva la sintesi proteica) a discapito della conformazione disattivata.
“Abbiamo usato la dinamica molecolare come una sorta di ‘microscopio virtuale’ con il quale abbiamo osservato la dinamica del processo”, ha spiegato Bussi. “Conoscere questi meccanismi di regolazione è molto importante. Sono infatti presenti in molti batteri – ma anche in organismi multicellulari – e potrebbero essere in futuro utili per creare nuovi antibiotici.”
Il lavoro di ricerca è stato svolto nel contesto di un finanziamento dell’European Research Council (ERC) coordinato da Bussi.
Più nel dettaglio…
Le simulazioni al calcolatore condotte in questa ricerca hanno utilizzato il software PLUMED, la cui ultima release è stata presentata in un’altra pubblicazione recente, sulla rivista Computer Physics Communications, firmata da Bussi. PLUMED è un software pensato per creare e analizzare simulazioni. “Per mettere a punto questa versione più avanzata del programma abbiamo lavorato in un team di cinque giovani ricercatori provenienti da istituti internazionali”.
Non è un caso che i ricercatori implicati in questo lavoro siano giovani: la ricerca è infatti stata tra l’altro finanziata con un grant dedicato proprio ai giovani ricercatori non-permanenti della SISSA, vinto da Bussi nel 2011.