 Una ricerca, che ha visto collaborare la Scuola Internazionale Superiore di Studi Avanzati (SISSA) di Trieste con l’Istituto Josef Stefan di Lubiana, ha analizzato come le mutazioni nel genoma dei virus basati sull’RNA siano solitamente letali per questi agenti infettivi. Basta poco infatti per rendere l’RNA troppo arruffato e voluminoso per entrare nel capside, il guscio che contiene il genoma del virus, mandando così a monte il processo riproduttivo.
Una ricerca, che ha visto collaborare la Scuola Internazionale Superiore di Studi Avanzati (SISSA) di Trieste con l’Istituto Josef Stefan di Lubiana, ha analizzato come le mutazioni nel genoma dei virus basati sull’RNA siano solitamente letali per questi agenti infettivi. Basta poco infatti per rendere l’RNA troppo arruffato e voluminoso per entrare nel capside, il guscio che contiene il genoma del virus, mandando così a monte il processo riproduttivo.
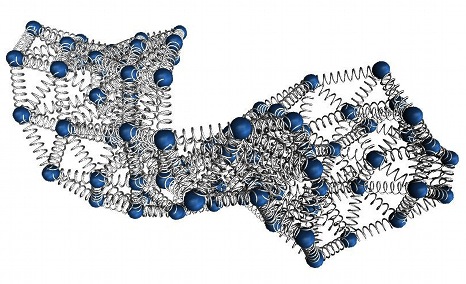
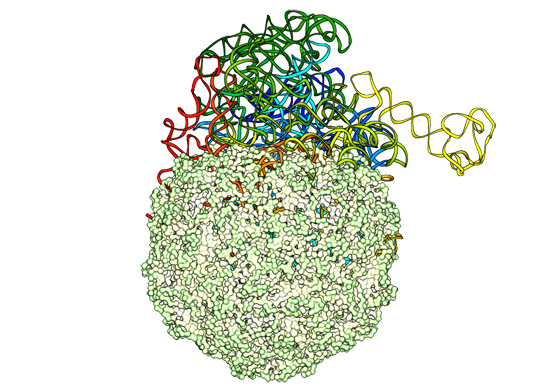
Per entrare nel capside, l’”esoscheletro” dei virus, l’RNA deve essere bello pettinato e “impacchettato”, perché altrimenti non riesce a starci dentro. L’impacchettamento dell’RNA è determinato dal genoma stesso. Sulla base di ricerche precedenti che hanno dimostrato che normalmente l’RNA del virus è ottimizzato per l’impacchettamento (fuori dal capside risulta solo poco più voluminoso del capside stesso), un team italo-sloveno di ricercatori, fra cui Cristian Micheletti della SISSA, ha verificato quali tipi di alterazione del genoma mantengono l’ottimizzazione e quali invece rendono l’RNA troppo voluminoso. Il risultato? “Anche mutazioni minori hanno un effetto dirompente che fa lievitare la matassa di materiale genetico”, spiega Micheletti, “e questo impedisce al virus di riprodursi”.
“L’idea da cui siamo partiti è che sull’RNA agiscano almeno due tipi di spinta evolutiva: quella sulle proteine sintetizzate dal virus, che ne determina il potere infettivo, e quella che ottimizza l’impacchettamento” spiega Luca Tubiana, primo autore assieme ad Anže Lošdorfer Božič , secondo autore dello studio, ex studente della SISSA ora postdoc nel gruppo di Rudolf Podgornik a Lubiana. “Ci chiedevamo quanto le mutazioni a livello della sintesi proteica, necessarie ai virus per sopravvivere all’azione di contrasto del sistema immunitario dell’ospite, (e più di recente dei farmaci), andassero a interferire con l’impacchettamento”.
Gli scienziati si aspettavano un effetto piuttosto contenuto, ma le osservazioni hanno mostrato l’esatto contrario. “Abbiamo prodotto, usando delle simulazioni al computer, delle mutazioni tutto sommato minori, dette ‘sinonime’, e quindi ci aspettavamo che queste avessero poco effetto sull’impacchettamento”, spiega Tubiana.
Le mutazioni sinonime cambiano la composizione dell’RNA ma non le proteine prodotte da questo attraverso la sintesi. Queste mutazioni infatti portano all’alterazione di un codone, la sequenza all’interno del gene che sceglie l’aminoacido da inserire nella “collana” che va a formare la proteina, ma l’aminoacido resta lo stesso, perché più codoni possono codificare lo stesso. “Anche con mutazioni dall’effetto così limitato le conseguenze sull’impacchettamento sono drammatiche”, continua Tubiana. La massa del RNA nella maggioranza dei casi diventa troppo voluminosa e non entra più nel capside.
Lo studio, che si è guadagnato la copertina dell’edizione del 6 genniao 2015 della rivista Biophysical Journal, aiuta a comprendere meglio i meccanismi di riproduzione dei virus e le condizione in questa si blocca.
Più in dettaglio…
Come si riproduce un virus? “I virus sono strane entità, a cavallo fra vivente e non vivente”, spiega Micheletti. “Non sono in grado di riprodursi da soli, come fanno altri patogeni come per esempio i batteri. I virus sono essenzialmente delle piccolissime navicelle con un guscio rigido in cui è contenuta una certa quantità di materiale genetico, a volte DNA, in altri casi come quello del nostro ultimo studio, RNA”. La navicella, continua Micheletti, entra e infetta una cellula, si insinua nel suo nucleo e si inserisce nel suo DNA forzandola a sintetizzare il proprio materiale genetico e le proteine che formano in capside del virus. “In pratica è come se il virus fosse una specie di criminale che entra a forza nella catena di montaggio di una fabbrica costringendo gli operai a produrre e assemblare i propri pezzi, in serie. La cellula produce nuovi virus finché è talmente piena da esplodere, rilasciandoli nell’ambiente pronti a infettare nuove cellule”.